Pengertian Air
 |
| Air, zat paling penting bagi kehidupan |
Air adalah substansi kimia dengan rumus kimia H2O,
satu molekul air tersusun atas dua atom hidrogen yang terikat secata kovalen
pada satu atom oksigen. Sifat fisik air yaitu tidak berwarna, tidak berasa dan
tidak berbau pada kondisi standar yaitu pada tekanan 100 kPa (1 bar) dan temperatur 273,15 K (00C). Zat kimia ini merupakan pelarut
penting yang memiliki kemampuan untuk melarutkan banyak zat kimia lainnya seperti garam, asam, gula, beberapa
jenis gas dan beberapa molekul organik.
Air sering disebut sebagai pelarut universal karena air mampu melarutkan
banyak zat kimia. Air berada dalam kesetimbangan dinamis antara fase cair dan
padat dibawah tekanan dan
temperatur standar. Dalam bentuk ion, air dapat dideskripsikan sebagai sebuah ion
hidrogen H2O yang berasosiasi atau berikatan dengan sebuah ion
hidroksida (OH-).
Perbedaan Air dan Es
Molekul air terbentuk
ketika dua atom hidrogen dan satu atom oksigen berikatan secara kovalen. Air
secara alamiah berbentuk cair. Ikatan hidrogen antara molekulnya secara konstan
terputus dan terbentuk kembali karena molekul air yang secara terus menerus
bergerak. Ikatan kovalen air lebih kuat dibandingkan ikatan hidrogen antar
molekul air. Pada keadaan cair hidrogen molekul air berikatan dengan
3-4 molekul air lainnya. Densitas air dalam bentuk cair adalah 1,00 g/cm3.
 |
| Air dalam wujud es |
Es merupakan bentuk
padat dari air yang memiliki struktur kaku. Es memiliki struktur intan karena satu atom H terletak diantara satu sisi atom
O membentuk suatu heksagonal simetris. Ikatan hidrogen es yang kuat berperan penting dalam pemberian bentuk dan densitas es itu sendiri. Es memiliki
ruang kosong pada struktur molekulnya sehingga memiliki densitas yang lebih
kecil (0,931 g/cm3) dari pada air. Pada bentuk es,
molekul air saling berikatan hidrogen dengan empat molekul air lainnya.
Molekul
Air
Molekul air terdiri dari dua atom hidrogen (H) dan satu
atom oksigen (O). Atom – atom hidrogen dan oksigen saling terikat dengan membagi
elektron mereka antara satu dan lainnya. Ikatan ini disebut ikatan kovalen. Menurut
Winarno (2004), sebuah molekul air digambarkan menempati pusat dari sebuah
tetrahedron. Sebuah molekul air memiliki kutub positif dan negatif sehingga
disebut dwikutub (dipolar). Karena itulah molekul air dapat berikatan dengan
senyawa lain yang bermuatan positif atau negatif. Daya tarik antara kutub
positif sebuah molekul air dengan kutub negatif molekul air lainnya menyebabkan
terjadinya ikatan antara air dan disebut ikatan hidrogen. Ikatan hidrogen lebih
lemah kekuatan pengikatnya
dibandingkan ikatan kovalen. Namun ikatan hidrogen memiliki efek yang besar
karena terdapat banyak ikatan hidrogen.
Struktur air tidak teratur namun molekul air saling
mendekat satu sama lain karena ikatan hidrogen. Berikut ini adalah
ilustrasi struktur molekul kimia ikatan hidrogen pada air.
 |
| Molekul air saling berikatan dengan ikatan hidrogen |
Sifat
Air
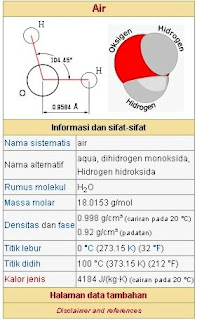 |
| Sifat-sifat air |
1.
Elektrolisis Air
Molekul air dapat
diuraikan menjadi unsur – unsur
asalnya dengan mengalirkan arus listrik. Proses ini
disebut elektrolisis air. Pada katoda, dua molekul air bereaksi dengan menangkap dua elektron, tereduksi
menjadi gas H2 dan ion
hidrokida (OH-). Sementara
itu pada anoda, dua molekul air lain terurai menjadi gas oksigen (O2), melepaskan empat ion H+ serta mengalirkan elektron ke katoda. Ion H+ dan OH- mengalami netralisasi sehingga terbentuk kembali beberapa
molekul air.
Gas hidrogen dan oksigen
yang dihasilkan dari rekasi ini membentuk gelembung pada elektroda dan dapat
dikumpulkan. Prinsip ini kemudian dimanfaatkan untuk menghasilkan hidrogen dan
hidrogen peroksida (H2O2) yang dapat digunakan sebagai bahan bakar kendaraan
hidrogen.
2. Kelarutan
(Solvensi)
Air adalah pelarut yang
kuat melarukan banyak jenis zat kimia. Zat – zat
yang bercampur dan larut dengan baik dalam air (misalnya
garam –
garam) disebut sebagai zat ‘hidrofilik’ dan zat-zat yang tidak mudah bercapur dengan
air (misalnya lemak) disebut zat ‘hidrofobik’.
Kelarutan suatu zat dalam air ditentukan oleh dapat tidaknya zat tersebut
menandingi kekuatan gaya tarik menarik listrik (gaya intermolekul dipol
– dipol) antara molekul – molekul air.
Jika suatu zat tidak mampu menandingi gaya tarik menarik antara molekul air,
molekul tersebut tidak terlarut dan mengendap dalam air.
3.
Kohesi dan
Adhesi
Air menempel pada
sesamanya (kohesi) karena air bersifat polar. Air memiliki sejumlah muatan
parsial negatif (σ-) dekat dengan atom
oksigen akibat pasangan elektron yang hampir tidak digunakan bersama dan
sejumlah muatan parsial positif (σ+) dekat dengan atom oksigen. Hal ini terjadi karena atom oksigen bersifat
lebih elektronegatif dibandingkan atom hidrogen. Sehingga atom oksigen memiliki
daya tarik pada elektron – elektron yang dimiliki bersama dalam molekul, menarik
elektron-elektron lebih dekat ke arahnya (juga menarik muatan negatif
elektron-elektron tersebut) dan membuat daerah disekitar atom oksigen bermuatan
lebih negatif dibanding daerah-daerah disekitar kedua atom hidrogen. Air memiliki sifat adhesi yang tinggi
karena sifat alami kepolarannya.
4.
Tegangan
Permukaan
Air memiliki tegangan
permukaan yang besar karena kuatnya sifat kohesi antara molekul-molekul air.
Hal ini teramati saat sejumlah air yang ditempatkan dalam permukaan yang tidak
dapat dibahasi (non soluble) air akan
berkumpul sebagai sebuah tetesan. Namun bila pada permuaan gelas yang sangat
halus atau bersih dapat terbentuk suatu lapisan tipis karena gaya tarik molekul
antara gelas dan molekul air (gaya adhesi) lebih kuat dibanding gaya kohesi
anatar molekul air.
Dalam sel
– sel biologi
air dan organel –
organel air bersentuhan dengan membran dan permukaan protein yang
bersifat ‘hidrofilik’. Irvin Langmuir mengamati suatu gaya yang kuat antara permukaan ‘hidrofilik’.
Untuk melepas lapisan yang terikat dengan kuat dari hidrasi air perlu dilakukan
kerja yang maksimal untuk melawan gaya ini yang disebut gaya hidrasi. Gaya
hidrasi ini memiliki nilai yang besar namun akan lemah dalam rentang nanometer
atau lebih kecil. pentingnya gaya-gaya tersebut dalam bidang biologi telah
dipelajari secara ekstensif oleh V. Adrian Paesegian dari National Institute of Healty. Gaya ini penting dipelajari terutama
antara sel-sel yang terhidrasi saat bersentuhan langsung dengan ruang luar yang
kering atau pendingin diluar sel (extracellular freezing).
Peranan
Air
Air mempunyai peranan penting didalam suatu bahan pangan.
Air merupakan faktor yang berpengaruh terhadap penampakan, tekstur, cita rasa,
nilai gizi bahan pangan, dan
aktivitas mikroorganisme. Karakteristik hidrasi bahan pangan merupakan karakter fisik yang meliputi
interaksi antara bahan pangan dengan molekul air yang terkandung didalamnya dan
molekul air di udara
sekitarnya.
Peranan air
dalam berbagai produk hasil pertanian dapat dinyatakan sebagai kadar air dan aktifitas
air. Sedangkan di udara dinyatakan dalam kelembaban relatif dan kelembaban
mutlak. Air dalam bahan pangan berperan sebagai pelarut dari beberapa komponen disamping
ikut sebagai pereaksi.
Dalam suatu
bahan pangan, air dikategorikan dalam 2 tipe yaitu air bebas dan air terikat.
Air bebas menunjukan sifat
– sifat air dengan
keaktifan penuh, sedangkan air terikat menunjukan air yang terikat erat dengan
komponen bahan pangan lainnya. Air bebas dapat dengan mudah hilang
apabila terjadi penguapan dan pengeringan, sedangkan air terikat sulit
dibebaskan dengan cara tersebut. Sebenarnya air dapat terikat secara fisik
yaitu ikatan menurut sistem kapiler dan air terikat secara kimiawi,
antara lain air kristal dan air yang terikat dalam sistem disperse.
Interaksi
Air
Air terikat (bound
water) merupakan interaksi air dengan solid atau bahan pangan. Ada beberapa
definisi, air terikat adalah sejumlah air yang berinteraksi secara kuat dengan solute yang bersifat hidrofilik. Air
terikat adalah air yang tidak dapat dibekukan lagi pada suhu lebih kecil atau
sama dengan -40oC, merupakan substansi nonaqueous dan mempunyai sifat berbeda dengan air kamba. Air dalam
bahan pangan terikat secara kuat pada sisi-sisi kimia komponen bahan pangan
misalnya grup hidroksil dari polisakarisa, grup karbonil dan amino dari protein
dari sisi polar lain yang dapat memegang air dengan ikatan hidrogen.
Menurut Wirakartakusumah dkk (1989) bahwa air dibagi atas empat tipe molekul air berdasarkan derajat keterikatan air dalam bahan pangan sebagai
berikut:
1. Tipe I, yaitu molekul air yang terikat secara kimiawi
dengan molekul –
molekul lain melalui ikatan hidrogen yang berenergi besar.
Derajat pengikatan air ini sangat besar sehingga tidak dapat membeku pada
proses pembekuan dan sangat sukar untuk dihilangkan dari bahan. Molekul air membentuk
hidran dengan molekul – molekul
lain yang mengandung atom – atom oksigen
dan nitrogen seperti karbohidrat, protein dan garam.
2. Tipe II, yaitu molekul air yang terikat secara kimia
membentuk ikatan hidrogen dengan molekul air lainnya. Jenis air ini terdapat
pada mikrokapier dan sukar dihilangkan dari bahan. Jika air tipe ini
dihilangkan seluruhnya maka kadar air bahan berkisar antara 3
– 7%.
3. Tipe III, yaitu molekul air yang terikat secara fisik
dalam jaringan –
jaringan matriks bahan seperti membran, kapiler, serat, dan lain-lain. Air tipe ini mudah dikeluarkan dari bahan
dan bila diuapkan seluruhnya kadar air bahan mencapai 12 – 25%. Air ini dimanfaatkan untuk pertumbuhan jasat renik dan merupakan media
bagi reaksi kimiawi.
4. Tipe IV, yaitu air bebas yang tidak terikat dalam
jaringan suatu bahan atau air murni dengan sifat-sifat air biasa dengan
sifat keaktifan penuh.
Menurut
Nagashima dan Suzuki (1981), air terikat meliputi:
1. Air
hidratasi
2. Air
dalam mikrokapiler atau air yang terjebak dalam mikrokapiler
3. Air
yang terabsorbsi pada permukaan solid
Air
terikat berhubungan dengan energi pengikatan yang tinggi. Energi pengikatan
merupakan istilah termodinamika yang menyatakan perbedaan antara panas absorbsi
air oleh solid dengan panas kondensasi uap air pada suhu yang sama. Berdasarkan
tingkat energi pengikatan, air terikat terbagi atas tiga fraksi yaitu:
1. Fraksi
air terikat primer
2. Fraksi
air terikat sekunder
3. Fraksi
air terikat tersier
Kadar Air
Kadar
air merupakan salah satu sifat fisik dari bahan yang menunjukkan banyaknya air
yang terkandung di dalam bahan. Kadar air biasanya dinyatakan dengan persentase
berat air terhadap bahan basah atau dalam gram air untuk setiap 100 gram bahan
yang disebut dengan kadar air basis basah (bb).
Kadar Air Keseimbangan
Kadar
air keseimbangan adalah kadar air dimana laju perpindahan air dari bahan ke
udara sama dengan laju perpindahan air dari udara ke bahan. Kadar air
keseimbangan dapat digunakan untuk mengetahui kadar air terendah yang dapat
dicapai pada proses pengeringan dengan tingkat suhu dan kelembaban udara
relatif tertentu. Menurut Heldman dan Singh (1981), kadar air keseimbangan dari
bahan pangan adalah kadar air bahan tersebut pada saat tekanan uap air dari
bahan seimbang dengan lingkungannya, sedangkan kelembaban relatif pada saat
terjadinya kadar air keseimbangan disebut kelembaban relatif keseimbangan.
Sifat-sifat
kadar air keseimbangan atau Equilibrium of Moisture Content (EMC)
dari bahan pangan sangat penting dalam penyimpanan dan pengeringan. Kadar air
keseimbangan didefinisikan sebagai kandungan air pada bahan pangan yang
seimbang dengan kandungan air udara sekitarnya. Hal tersebut merupakan satu
faktor yang menentukan sampai seberapa jauh suatu bahan dapat dikeringkan pada
kondisi lingkungan tertentu (aktivitas air tertentu) dan dapat digunakan
sebagai tolak ukur pencegahan kemampuan berkembangnya mikroorganisme yang
menyebabkan terjadinya kerusakan bahan pada saat penyimpanan.
Kadar air keseimbangan (equilibrium moisture content)
adalah kadar air minimum yang dapat dicapai pada kondisi udara pengeringan yang
tetap atau pada suhu dan kelembaban relatif yang tetap. Suatu bahan dalam
keadaan seimbang apabila laju kehilangan air dari bahan ke udara sekelilingnya
sama dengan laju penambahan air ke bahan dari udara di sekelilingya. Kadar air pada
keadaan seimbang disebut juga dengan kadar air keseimbangan atau keseimbangan
higroskopis.
Dalam
percobaan menentukan kadar air keseimbangan, kondisi termodinamika udara (suhu
dan kelembaban relatif) harus konstan. Penentuan kadar air keseimbangan ada dua metode yaitu metode dinamis dan statis. Metode dinamis, kadar air keseimbangan bahan diperoleh pada keadaan
udara yang bergerak. Metode dinamik biasanya digunakan untuk pengeringan,
dimana pergerakan udara digunakan untuk mempercepat proses pengeringan dan
menghindari penjenuhan uap air disekitar bahan. Sedangkan metode statis, kadar
air keseimbangan bahan diperoleh pada keadaan udara diam. Metode statik
biasanya digunakan untuk keperluan penyimpanan karena umumnya udara disekitar
bahan relatif tidak bergerak.
Aktivitas Air
Dalam
bahan pangan, air berperan sebagai pelarut yang digunakan selama proses
metabolisme, dimana kandungan air suatu bahan pangan tidak dapat digunakan
sebagai petunjuk nyata dalam menentukan ketahanan simpan. Tingkat mobilitas dan
peranan air dalam bahan pangan bagi proses kehidupan biasanya dinyatakan dengan
aktivitas air atau water activity (Aw) yaitu jumlah air bebas
yang dapat digunakan oleh mikroorganisme untuk pertumbuhannya. Berbagai jenis
mikroorganime yang yang dapat hidup pada nilai Aw tertentu dapat
dilihat pada Tabel berikut:
Tabel Nilai
Aw yang
dapat Ditumbuhi Mikroorganisme
Mikroorganisme
|
Aktivitas air
|
Organisme penghasil
lendir pada daging
|
0,98
|
Spora Pseudomonas, Bacillus cereus
|
0,97
|
Spora B. subtilis, C. botulinum
|
0,95
|
C. botulinum, Salmonella
|
0,93
|
Bakteri pada umumnya
|
0,91
|
Ragi pada umumnya
|
0,88
|
Aspergillus niger
|
0,85
|
Jamur pada umumnya
|
0,80
|
Bakteri halofilik
|
0,75
|
Jamur Xerofilik
|
0,65
|
Ragi Osmofilik
|
0,62
|
Aktivitas
air juga dinyatakan sebagai potensi kimia yang nilainya bervariasi dari 0
sampai 1. Pada nilai aktivitas air sama dengan 0 berarti molekul air yang
bersangkutan sama sekali tidak dapat melakukan aktivitas dalam proses kimia.
Sedangkan nilai aktivitas air sama dengan 1 berarti potensi air dalam proses
kimia dalam kondisi maksimal.
Aktivitas
air merupakan salah satu parameter hidratasi yang sering diartikan sebagai air
dalam bahan yang digunakan untuk pertumbuhan jasad renik. Scott (1957) dalam
Purnomo (1995), pertama kali menggunakan aktivitas air sebagai petunjuk adanya
sejumlah air dalam bahan pangan yang dibutuhkan bagi pertumbuhan
mikroorganisme. Aktivitas air ini juga terkait erat dengan adanya air dalam
bahan pangan.
Aktivitas
air didefinisikan sebagai perbandingan antara tekanan uap air dari larutan
dengan tekanan uap air murni pada suhu yang sama.
Interaksi Air dengan Gula
Molekul-molekul
berbagai senyawa di dalam bahan pangan umumnya terikat satu sama lain dengan
ikatan hidrogen, contohnya molekul gula.
Bila sebuah kristal gula melarut, molekul-molekul air bergabung secara
ikatan hidrogen pada gugus polar molekul gula yang terdapat di permukaan air
kristal gula tersebut. Molekul-molekul air yang semula terikat pada lapisan
pertama ternyata tidak dapat bergerak, tetapi selanjutnya molekul-molekul gula
akhirnya dikelilingi oleh lapisan air dan melepaskan diri dari kristal (Winarno,
2004).
Ikatan
hidrogen air dan zat terlarut lebih lemah dibandingkan dengan interaksi ion
dengan air. Ikatan hidrogen pada air
dapat terjadi pada beberapa gugus lain seperti hidroksil (O-H), amino (NH2),
carbonil (C=O), amida, dan imino, contoh ikatan hidrogen antara gugus amina dan
karbonil terhadap molekul air.
H
Ikatan
hidrogen (garis titik-titik) antara air dan dua gugus fungsional amina dan
karbonil (Fennema, 1996).
Perbedaan
antara larutan murni dengan dispersi koloidal terletak pada ukuran molekul dan
partikel yang terlibat dan juga luas relatif permukaannya. Dalam bentuk dispersi koloidal,
partikel-partikel yang ada dalam air bentuknya tidak begitu besar sehingga
tidak dapat mengendap, tetapi juga tidak cukup kecil untuk dapat membentuk
larutan, contohnya protein gelatin yang dapat membentuk dispersi koloidal dalam
air panas, juga kasein susu. Sementara
suspensi juga termasuk jenis dispersi, hanya saja partikel-partikel yang
terlibat terlalu besar dan kompleks sehingga tidak dapat larut dan juga tidak
dapat membentuk koloidal, contohnya pati dalam air dingin.

makasih-makasih artikel anda sngat membantu
BalasHapusSama sama, jangan lupa minum air, hahaaa
Hapus